
Anécdotas de la ciencia (química)
Pese a que han transcurrido ya cincuenta años, recuerdo todavía las clases de mi profesor de química en COU, el cual nos la enseñaba -y sabía mucha- desde un enfoque histórico y, si se me apura, anecdótico, lo que me permitió aprenderla de una manera amena e influyó de manera decisiva en mi elección posterior de estudiar esta disciplina en la universidad. Aquí intento recoger su testigo, dedicando este artículo a lo que he denominado anécdotas científicas aunque muchas de ellas si no todas de anecdóticas tienen poco. Lo que sí pretendo es contar episodios interesantes o curiosos de forma que estén al alcance de todos y les diviertan, o cuanto menos llamen su atención lo suficiente como para llegar hasta el final.
Dada su naturaleza rehúyo las explicaciones prolijas o aptas tan sólo para entendidos, así como de citas bibliográficas o reseñas que considero innecesarias dado que mi principal fuente de información ha sido internet y quien quiera profundizar en alguno de estos temas no tiene más que introducir su nombre en el buscador para encontrar toda la información que desee. Huelga decir que éste no es un trabajo de investigación ni pretende serlo y ni tan siquiera es original, ya que me he limitado a buscar y a extractar las historias que me interesaban, muchas de ellas oídas por vez primera a mi profesor.
Aunque en principio lo estructuré como un artículo único, su crecimiento recomendó dividirlo en varios siguiendo criterios temáticos aunque no estrictos, cuatro por el momento dedicados a la astronomía, la física, las matemáticas y éste a la química. Esta clasificación no es definitiva, y podrá variar en un futuro dependiendo de las circunstancias.
¿Héroe o asesino?

Fritz Haber
Pese a que a diferencia de los controvertidos Premios Nobel de la Paz o de Literatura, los científicos deberían ser teóricamente más objetivos, el caso de Einstein no fue el único. Otro Nobel polémico fue el de Química de 1918, otorgado al químico alemán Fritz Haber por su descubrimiento de la síntesis del amoníaco, un compuesto fundamental en la industria química siendo una de sus aplicaciones la fabricación de abonos nitrogenados; también la de explosivos, pero ésta es otra historia.
Hasta entonces la única fuente natural de nitratos, la materia prima para estos fertilizantes, eran los enormes depósitos de guano -acumulaciones de excrementos de aves marinas- existentes en las islas o en territorios costeros del litoral pacífico sudamericano, principalmente los pertenecientes a Perú y Chile. Durante el siglo XIX fue un material estratégico del que los países desarrollados dependían de una manera similar a la que ocurre hoy en día con el petróleo, lo que llegó a provocar conflictos diplomáticos en incluso estuvo por medio de guerras como la del Pacífico entre España y la coalición de Chile y Perú entre 1865 y 1866, o la también llamada así que enfrentó a Chile con Perú y Bolivia entre 1879 y 1884.
El proceso de Haber, que es como se conoce a la síntesis del amoníaco a partir del nitrógeno atmosférico, acabó con el monopolio del guano al poderse obtener los abonos nitrogenados necesarios para la agricultura por procedimientos químicos sin dependencias externas, al tiempo que permitió incrementar notablemente el rendimiento agrícola. Así pues, excepto desde el punto de vista de los perjudicados exportadores de guano, no cabe la menor duda de que Haber se merecía sobradamente el galardón.
Pero... el mismo Haber que desarrolló la síntesis del amoníaco en 1911 fue el director del Departamento de Guerra Química del Ministerio de Guerra alemán durante la I Guerra Mundial, que utilizó gases tóxicos tales como el cloro, el fosgeno -dicloruro de carbonilo- o la terrible iperita o gas mostaza, un compuesto vesicante que en contacto con la piel, la córnea o las mucosas internas ocasiona úlceras de muy difícil curación. Y si bien por un lado salvó vidas alejando los riesgos de malas cosechas y hambrunas, por otro sembró la muerte y el horror en las trincheras.
Obviamente el Nobel le fue concedido por la síntesis del amoníaco y no por la guerra química, pero en 1918 las heridas de la I Guerra Mundial estaban todavía abiertas, por lo que era inevitable que la decisión del Comité Nobel resultase controvertida. Incluso la vida personal de Harber, que no renegó en ningún momento de su responsabilidad justificando la obligación de apoyar a su país en guerra, se vería afectada: su esposa, disconforme con sus actividades, se suicidó en 1915.
Años después, pese a su origen judío, los nazis le ofrecieron continuar sus investigaciones con armas químicas, a lo cual se negó exiliándose de Alemania y logrando que, paradójicamente, el régimen nazi acabara renegando de él y difamándolo al tiempo que aprovechaba sus descubrimientos anteriores para desarrollar venenos como el Zyklon B, de triste recuerdo por su uso en los campos de exterminio.
Harber falleció en Basilea en 1934, a los 65 años, de insuficiencia cardíaca. ¿Héroe? ¿Asesino? ¿O quizás tan sólo una víctima de las contradicciones de la difícil época en que le tocó vivir? Porque, ¿acaso fue menos asesino que quienes desarrollaron las bombas atómicas de Hiroshima y Nagasaki, o quienes lo hicieron con las bombas incendiarias que arrasaron Tokio o Dresde?
El sueño de Kekulé
August Kekulé
Hora es que dejemos de hablar de desgracias y recordemos un acontecimiento feliz, el del descubrimiento de la estructura de la molécula de benceno.
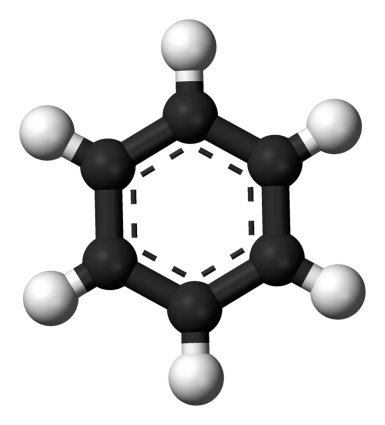
El benceno, como sabemos ahora, es un hidrocarburo cuya molécula tiene la forma de un hexágono plano, con seis carbonos unidos entre sí por enlaces sencillos y dobles alternados -en realidad experimentan un fenómeno denominado resonancia electrónica, pero no es necesario profundizar en este punto- y cada uno de ellos con otros tantos hidrógenos que forman una a modo de corona alrededor del anillo. Del benceno deriva toda una familia de compuestos que por razones históricas se denominan hidrocarburos aromáticos, y los anillos bencénicos revisten una gran importancia en diferentes campos de la química orgánica, desde los hidrocarburos o los polímeros hasta multitud de moléculas bioquímicas.
Pero a mediados del siglo XIX la situación era muy distinta. Se sabía que su fórmula química era C6H 6 y se conocían sus propiedades físicas y químicas, pero la forma de colocar esos doce átomos en una molécula se convirtió en un quebradero de cabeza para los químicos, ya que ninguna de las estructuras que se planteaban conseguía encajar con los resultados experimentales.
Uno de estos químicos era August Kekulé, un científico alemán que previamente había estudiado la tetravalencia del carbono, es decir su capacidad de enlazarse con hasta otros cuatro átomos, así como la de poder hacerlo consigo mismo formando cadenas. Pero la estructura de la molécula de benceno se le resistía también a él.
 |
 |
|
Uróboros (izquierda) y modelo de la molécula de benceno (derecha) |
|
Hasta que un día... la historia, aunque suena fantástica, fue contada por él mismo. Kekulé llevaba tiempo dándole vueltas al rompecabezas, pero seguía sin poder encajar todas las piezas. Hasta que un día, a principios de 1862, se quedó adormilado y tuvo la ensoñación de una serpiente mordiéndose la cola, un símbolo mitológico y alquímico conocido como Uróboros que representa el ciclo eterno.
Pese a que en principio no parecería existir vínculo alguno entre esta vieja alegoría y la estructura de un compuesto químico, Kekulé experimentó su particular ¡eureka! de modo que cuando despertó pudo comprobar que una estructura anular encajaba a la perfección con la escurridiza forma de la molécula de benceno. La ciencia había dado un nuevo paso.
Una muerte evitable

Henry Moseley
Volvemos a la cara oscura de la historia de la ciencia para recordar un caso hasta cierto punto similar al de Galois, aunque las circunstancias fueron diferentes y en éste no hubo temeridad alguna por parte del afectado, aunque quizás sí por sus superiores, saldado también con la pérdida de su vida.
Me estoy refiriendo a Henry Moseley, uno de los más importantes físicos de principios del siglo XX y eso que estamos hablando de científicos de la talla de Einstein, Rutherford, Bohr, Heisenberg, Planck, Schödringer, Pauli, Dirac, de Broglie o Fermi, entre muchos otros. Pero antes de esbozar una pequeña biografía de Moseley, resulta necesario retroceder unas cuantas décadas para disponer de la necesaria perspectiva histórica.
A mediados del siglo XIX los químicos habían descubierto un considerable número de elementos químicos, pasando de los 33 conocidos en 1800 a los 59 de 1850, planteándose el problema de su clasificación. Se sabía que algunos de ellos presentaban propiedades químicas y físicas parecidas, como era el caso del litio, el sodio y el potasio, o el del flúor, el cloro y el bromo; pero aunque se habían hecho algunos intentos parciales se estaba lejos de encajar todas las piezas y, por si fuera poco, los nuevos descubrimientos lo complicaban todavía más.
El acierto de organizarlos en una única tabla, que recibió el nombre de periódica dado que las propiedades de los elementos se repetían periódicamente le correspondió al químico ruso Dimitri Mendeleiev, aunque su figura oscurece al alemán Lothar Meyer que también desarrolló la suya de forma paralela publicándola tan sólo un año después.
Para hacerlo Mendeleiev se basó en una propiedad de los elementos que ya se conocía con suficiente precisión, la masa atómica, aunque todavía se estaba lejos de conocer la estructura de los átomos. Lo que hizo ahora nos parece sencillo, pero entonces supuso una enorme intuición: tomó los 63 elementos conocidos y empezando por el elemento más ligero, el hidrógeno, los fue colocando en una fila horizontal en orden creciente de masas atómicas. Cuando comprobaba que las propiedades químicas se repetían, saltaba a una fila inferior comenzando por el principio, de manera que los elementos químicos con propiedades afines formaban columnas verticales a las que llamó familias.
El método funcionó bastante bien y de hecho la tabla de Mendeleiev es, con algunas modificaciones, la misma que empleamos ahora. No obstante se vio obligado a resolver dos cuestiones que se le plantearon, el de los elementos que todavía no habían sido descubiertos, que solucionó dejando los huecos vacíos, y los casos en los que en la ordenación por masas atómicas quedaban pares de elementos cambiados, que se limitó a invertir.
El resultado final era completamente funcional y permitió la inclusión de los nuevos elementos descubiertos con posterioridad, por lo que la tabla periódica fue adoptada sin problemas por los químicos. Pero a los físicos no acababa de gustarles su naturaleza empírica, por lo que deseaban encontrar una explicación teórica que además evitase la necesidad de introducir excepciones. Ésta llegaría con el desarrollo de los modelos atómicos que describían su estructura interna, pero el primero de ellos, el de Bohr, data de 1913 y no dejó de ser una primera aproximación, mientras el modelo cuántico, que es el actual, fue propuesto por Schrödinger en 1926. Esto sin contar con que las partículas subatómicas también tardaron bastante en ser identificadas: el electrón fue el primero en 1897, el protón en 1918 y para el neutrón hubo que esperar hasta 1932.
Así pues, a principios del siglo XX seguía sin conocerse una interpretación teórica de la tabla periódica; y es ahora cuando entra en escena nuestro biografiado. Henry Moseley había nacido en 1887 y recibió una esmerada educación, siendo alumno del afamado Ernest Rutherford. Pronto destacó en sus investigaciones y en 1913, con apenas 26 años, definió el número atómico, que reemplazó a la masa atómica en la ordenación de la tabla periódica, pudiéndose interpretar ésta al fin de forma teórica.
El trabajo de Moseley consistió en analizar los espectros de rayos X de una cincuentena de elementos químicos, descubriendo que todos ellos contaban con un registro específico que los diferenciaba del resto; en lenguaje coloquial podríamos decir que estos espectros constituían el equivalente a su huella dactilar o al número de DNI.
Aún más, determinó que existía una relación entre la raíz cuadrada de la frecuencia del pico principal, denominada Ka, del espectro y el número atómico del elemento, definido este último como el número de orden de la casilla que le corresponde en la tabla periódica. Es la denominada Ley de Moseley, que permitía además identificar a un elemento en una muestra desconocida midiendo la frecuencia principal de su espectro de rayos X y calculando el número atómico a través de la ley.
Ahora sabemos que el número atómico corresponde al número de protones existentes en el átomo y que es el que determina las propiedades químicas del mismo, pero entonces todavía no se había descrito al protón y la estructura atómica estaba todavía en mantillas. Con toda probabilidad Moseley habría seguido investigando sumando sus trabajos a todos aquellos estudios que acabaron permitiendo el desarrollo de la mecánica cuántica, pero la fatalidad se atravesó en su vida.
Tras el estallido de la I Guerra Mundial se alistó en el ejército británico -el servicio militar obligatorio no se introdujo en Gran Bretaña hasta enero de 1916-, siendo destinado a una de las unidades que intervinieron en la batalla de Galípoli, una carnicería en la que tan sólo los británicos sufrieron 250.000 bajas; entre ellas la de Moseley, muerto el 10 de agosto de 1915 sin llegar a cumplir los 28 años.
Sólo podemos aventurar lo que podría haber aportado a la ciencia de no haberse interpuesto una bala en su vida.
Un gas “extraterrestre”
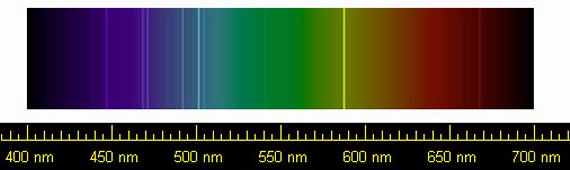
Espectro del
helio
La historia del descubrimiento de los elementos químicos, además de apasionante, daría por sí sola para varios libros... que ya están escritos. Obviamente resultaría excesivo relatarla aquí, pero no puedo evitar la tentación de relatar el caso de uno de ellos por la singularidad que tuvo descubrirlo fuera de la Tierra antes de hacerlo aquí; y no me estoy refiriendo a un hallazgo realizado por la NASA o cualquier otra agencia espacial puesto que tuvo lugar en 1868, mucho antes de que la astronáutica diera sus primeros pasos.
Me estoy refiriendo al helio, el segundo elemento más ligero después del hidrógeno y el que encabeza en la tabla periódica la familia de los gases nobles junto con el neón, el argón, el kriptón, el xenón y el radón. El helio, un gas inerte que no reacciona con ningún otro elemento o compuesto químico, resulta familiar dado que su utilidad más habitual es el llenado de globos, desde los meteorológicos y en su día los dirigibles, hasta los globos de goma con los que juegan los niños, aunque evidentemente tiene otros usos. Su gran ligereza hace que sus átomos asciendan hasta las capas altas de la atmósfera, siendo preferible su uso al del hidrógeno, pese a su menor poder ascensional, dado que evita los riesgos inherentes a la inflamabilidad del hidrógeno.
El helio, tal como he anunciado, no fue descubierto por primera vez en la Tierra, sino en el Sol. Obviamente nadie fue allí a tomar una muestra que pudiera ser analizada en un laboratorio, sino que se descubrió gracias a la espectroscopía. Isaac Newton fue el primero que en 1672 logró desdoblar la luz solar, haciéndola pasar a través de un prisma transparente, en un conjunto de colores similares a los del arco iris, pero no fue hasta 1815 cuando el físico y astrónomo alemán Joseph von Fraunhofer estudió en detalle el espectro solar, es decir la descomposición de la luz solar en sus componentes.
La espectroscopía no tardó en aplicarse a diferentes gases, metales o compuestos químicos en el laboratorio, mostrándose como una técnica de análisis extremadamente útil ya que, como pronto se descubrió, los espectros eran característicos de cada elemento químico, pudiéndose identificar la naturaleza de éstos sin necesidad de realizar análisis químicos en ocasiones complejos e incluso fueron varios los elementos del sistema periódico que se descubrieron mediante técnicas espectroscópicas antes de ser aislados químicamente.
Asimismo importante fue descubrir que gracias al estudio de los espectros luminosos de objetos tan inaccesibles como el Sol, las estrellas o los planetas, se pudieron identificar los elementos que los constituían, ya que éstos eran similares a sus homólogos terrestres. Con el tiempo la espectroscopía se aplicaría también a otros rangos de la radiación electromagnética como el infrarrojo, el ultravioleta o los rayos X, pero este tema se sale de nuestro ámbito.
Pero no todo acababa de encajar. En 1868 el astrónomo francés Pierre Janssen y su colega inglés Norman Lockyer descubrieron por separado unas líneas del espectro solar que no concordaban con las de ningún elemento químico conocido, por lo que postularon la presencia en el Sol de un elemento inexistente en la Tierra que fue bautizado como helio, en homenaje al dios griego Helios que simbolizaba al Sol.
Sin embargo el helio sí existía en la Tierra, aunque no fue descubierto en nuestro planeta hasta 1882, también por métodos espectroscópicos, por el físico italiano Luigi Palmieri. Posteriormente en 1895 el afamado químico inglés William Ramsay logró aislarlo en estado puro extrayéndolo de una variedad de uranita, un mineral de uranio. Por último, ya a principios del siglo XX, se descubrió que el helio existía en estado libre mezclado con otros gases en yacimientos de gas natural, de donde se sigue extrayendo en la actualidad.
El éxito del descubrimiento extraterrestre del helio condujo paradójicamente a otros descubrimientos erróneos. Durante la observación de un eclipse solar en 1869 los astrónomos Charles Augustus Young y William Harkness descubrieron, también por separado, unas líneas desconocidas en el espectro de la corona solar, sólo visible durante los eclipses totales. Siguiendo la línea de sus colegas las atribuyeron a un nuevo elemento químico, al que llamaron coronio en alusión a su procedencia aunque posteriormente sería renombrado como newtonio. No fue sino hasta la década de 1930 cuando se demostró que el espectro del coronio correspondía en realidad a átomos de hierro altamente ionizados, es decir que habían perdido un gran número de electrones en las condiciones extremas de la corona solar, por lo que no existen como tales en la Tierra.
Otro error similar fue el del nebulio, identificado espectroscópicamente en la nebulosa -de ahí su nombre- NGC 6543 Ojo del Gato en 1864, algunos años antes del descubrimiento del helio. El error se perpetuó durante décadas en 1927 se demostró que el espectro correspondía a átomos de oxígeno doble o triplemente ionizados en una condiciones que, como en el caso anterior, no existen en nuestro planeta.
Cuestión de pegajosidad

Taco de notas post-it.
Fotografía tomada de la
Wikipedia
Tal como he comentado anteriormente la chiripa, impropiamente llamada en español serendipia, ha jugado un papel importante en el campo de la ciencia. Veamos dos ejemplos pegajosos de ella.
Los pegamentos siempre han sido unas sustancias usadas para diversos fines. En principio fueron de origen natural como la cola obtenida del colágeno de los peces cociendo las colas y las aletas -de ahí su nombre-, el engrudo elaborado con harina, la cera de abeja o el caucho natural, entre otros. Tiempo después se desarrollarían los pegamentos sintéticos, y aquí es donde comienza la historia de dos fracasos iniciales que acabaron dando resultados no previstos y a la larga sumamente exitosos.
En 1942 el químico norteamericano Harry Wesley Coover trabajaba para la empresa Eastman Kodak investigando polímeros con los que poder fabricar visores transparentes para ser utilizados en los visores de los fusiles; recordemos que Estados Unidos estaba entonces inmerso en la II Guerra Mundial. Estudiando uno de ellos se le adhirió a los prismas de un refractómetro con el que quería medir sus propiedades ópticas, resultando imposible limpiar el aparato al no poderse eliminar el tenaz polímero. Sin saberlo, y por supuesto sin pretender estropear irreversiblemente el delicado refractómetro, había descubierto al azar un pegamento de excepcionales propiedades adhesivas y solidificación instantánea, el cianocrilato, aunque en ese momento no valoró su potencial. Años después, ya terminada la guerra, Coover volvió a investigarlo apercibiéndose de su utilidad potencial, aunque no para los usos que había buscado sino como adhesivo. En 1958 se inició su fabricación y comercialización, convirtiéndose en uno de los pegamentos más utilizados actualmente. Aunque existen muchas marcas en el mercado, es conocido popularmente como loctite dado que fue esta compañía, tras cederle la patente Eastman Kodak, quien lo popularizó a partir de la década de 1960.
No menos curiosa es la historia de los post-it -otro nombre comercial, éste admitido por la RAE junto con la variante pósit-, esas etiquetas autoadhesivas que todos usamos para marcar páginas o dejar notas escritas, aunque paradójicamente se desarrolló en el sentido opuesto al anterior. En 1968 Spencer Ferguson Silver, también químico, trabajaba para la empresa 3M Company buscando un adhesivo extrafuerte que pudiera ser utilizado en la industria aeroespacial. Sin embargo uno de sus ensayos dio por resultado un compuesto que como pegamento era una auténtica birria, ya que su capacidad adhesiva era muy pequeña y se despegaba con facilidad, pero al mismo tiempo no perdía sus propiedades pudiéndose volver a pegar. Aunque Silver no fue capaz de prever la importancia de su accidental descubrimiento un colega suyo, Art Fry, fue el primero en aplicarlo en 1974 a un rectángulo de papel coloreado en forma de banda estrecha por uno de sus extremos; acababa de nacer el post-it. Su distribución comenzó en 1977 de forma limitada, y su comercialización a gran escala a partir de 1980 en los Estados Unidos y un año más tarde en Canadá y Europa. Se da la coincidencia de que el adhesivo de los post-it pertenece también a la familia de los acrilatos, aunque su estructura molecular es diferente de los cianoacrilatos.
Curiosidades del latón

Jarra persa de latón del
siglo VII
El latón, una de las aleaciones más comunes, está compuesto por una mezcla de cobre y zinc en proporciones variables, aunque las más habituales son entre un 35 y un 44 % de zinc y el resto de cobre. Al igual que el bronce se conoce desde la prehistoria, pero existe una importante diferencia entre ambos: mientras el cobre y el estaño que forman el bronce ya eran conocidos por separado hace miles de años, el zinc no fue descubierto hasta 1746 por el químico alemán Andreas Marggraf. Extraño, ¿no?
Para comprender esta aparente paradoja conviene explicar primero qué significa el descubrimiento de un elemento químico, algo que además ha variado con el tiempo. En esencia, se considera que un elemento químico nuevo ha sido descubierto cuando se identifica por vez primera de forma inequívoca su existencia... lo cual en la práctica no siempre resultaba sencillo. En primer lugar, porque hasta bien entrado el siglo XVIII no se empezó a diferenciar entre los elementos puros y los compuestos, e incluso hasta bastante después, ya en el siglo XIX, no se logró identificar a los primeros sin margen de error.
Pero no sólo eso. Inicialmente se recurrió a la química analítica, aislando los elementos puros a partir de sus compuestos mediante reacciones químicas, pero más adelante se desarrollaron técnicas como la espectroscopía capaces de identificar a un elemento determinado sin necesidad de aislarlo previamente del compuesto al que pertenecía; incluso se llegó a dar el caso, como comento en este mismo artículo, de que el helio, muy escaso en la Tierra pero extremadamente abundante en el Sol, fue identificado antes en éste mediante técnicas espectroscópicas que en nuestro planeta. Por último, la síntesis de elementos radiactivos e inestables -los más pesados de la tabla periódica, inexistentes en estado natural- mediante procesos de transmutación nuclear sólo puede ser comprobada mediante unos sofisticados y complejos métodos de detección.
Pese a lo cual se siguieron cometiendo errores. El didimio, un metal perteneciente al grupo de los lantánidos, también conocidos como tierras raras, fue descubierto por el químico sueco Carl Gustaf Mosander, en 1841... hasta que en 1879 el químico francés, Paul Émile Lecoq separó de éste el samario, otro lantánido. Y por si fuera poco el austríaco Carl Auer von Welsbach demostró en 1885 que el didimio era en realidad una mezcla de otros dos lantánidos de propiedades químicas muy parecidas, el praseodimio y el neodimio.
Asimismo, tal como también he comentado en el apartado dedicado al descubrimiento del helio, otros astrónomos intentaron emularlo descubriendo otros presuntos gases como el coronio -en la corona solar- o el nebulio -en la nebulosa NGC 6543-, en realidad átomos tan comunes como el hierro y el oxígeno altamente ionizados, es decir privados de varios de sus electrones en un estado que no se da en la Tierra, lo que motivó las confusiones.
Pero que no se hubiera logrado identificar un elemento químico, fuera de la forma que fuera, no quiere decir que no se le pudiera conocer en forma de alguno de sus compuestos, máxime si se trataba de una época en la que todavía no se había definido con claridad la diferencia entre unos y otros. Y éste fue precisamente el caso del latón, porque para obtenerlo no era necesario disponer previamente de los dos metales que lo componen en estado puro.
De hecho, lo que hacían los metalúrgicos antiguos era mezclar minerales de cobre y zinc, en el caso de este último la calamina, obteniéndose el latón metálico tras los procesamientos adecuados, un proceso totalmente empírico pero eficaz. Puesto que el latón presenta un color dorado y una textura similares a los del oro fue muy apreciado por los antiguos, que lo consideraban un metal valioso utilizándose como sustituto de éste en elementos decorativos como lámparas, vajillas, tiradores, campanillas o medallas, o bien para la acuñación de monedas. En la actualidad tiene otros muchos usos, desde cerraduras, grifos y almireces hasta instrumentos musicales como la familia de viento metal -trompetas, trompas, trombones y tubas- o los platillos.
Ver también:
Anécdotas de la ciencia
(astronomía)
Anécdotas de
la ciencia (física)
Anécdotas de la ciencia
(matemáticas)
Publicado el 12-12-2024
Actualizado el
12-11-2025
