
Sólido, líquido, gaseoso y...

El agua en sus tres estados:
hielo, agua líquida y vapor en las nubes
Cuando íbamos al colegio -no sé ahora- siempre nos decían que los estados de la materia eran tres: sólido, líquido y gaseoso, añadiendo que las características de cada uno de ellos eran que los sólidos contaba con forma y tamaño propios, los líquidos sólo con tamaño propio mientras su forma era variable, mientras un gas no tenía ni forma ni tamaño propios. Aunque esta definición dejaba sin explicar algunos materiales tales como los áridos, sólidos pulverulentos como la arena cuyo comportamiento se asemeja en algunos aspectos al de los líquidos, en realidad resultaba ser aceptablemente precisa dentro de su sencillez.
La cosa empezó a complicarse cuando descubrí en los periódicos, todavía siendo un niño, la existencia del plasma, definido como el cuarto estado de la materia. En realidad el plasma no deja de ser un gas y cuenta con sus mismas propiedades, diferenciándose de los gases “normales” en que sus partículas están ionizadas, es decir, cargadas eléctricamente, siendo sensible por ello a la aplicación de un campo eléctrico o magnético a diferencia de los gases neutros.

El Sol, al igual que cualquier
otra estrella, es una inmensa esfera de plasma
Ahora bien, independientemente de que se considere o no al plasma como un estado de la materia propio, ¿existen más de éstos aparte del plasma y de los tres tradicionales? Pues... sí y no, según como se mire.
En realidad, lo que ocurre es que la tajante definición de estos tres estados resulta ser, en la práctica, insuficiente, dado que es posible encontrar lo que podríamos denominar fases intermedias entre ellos... y a diferencia del plasma no son tan extrañas como pudiera parecer sino, por el contrario, bastante habituales.
Fijémonos en el estado sólido. Todos sabemos, de forma intuitiva lo que es un sólido, pero a poco que profundicemos en su estructura interna empezaremos a descubrir notables diferencias. La primera de ellas nos permite dividirlos en dos grandes grupos, los cristales y los vidrios.
Vaya por delante una advertencia: los términos químicos cristal y vidrio no tienen nada que ver -de hecho el primero es antagónico- con sus equivalentes en el lenguaje común, dándose la paradoja de que lo que habitualmente consideramos “cristales” -los de las ventanas, o los de las botellas- no lo son en absoluto desde un punto de vista químico. Así pues, les ruego que, haciendo un pequeño esfuerzo mental, se olviden de analogías que podrían inducirles a confusión.
Veamos un sólido por “dentro”, es decir, consideremos su estructura más íntima. Los sólidos, al igual que los líquidos y los gases, están constituidos por partículas que, según los casos, podrán ser átomos, moléculas o iones -cualquiera de los dos anteriores cargados eléctricamente-, pero que, a diferencia de ellos se encuentran inmovilizadas. Dicho con otras palabras los sólidos mantienen fija su estructura, lo que hace que su forma -dentro, claro está, de ciertos márgenes- no varíe.
Ahora bien, la manera de distribuirse estas partículas reviste una importancia capital a la hora de determinar la estructura de un sólido. Para empezar, podemos imaginar dos casos límite, el de una estricta ordenación geométrica de las mismas y el de una distribución al azar. Son los que corresponden, respectivamente, a los cristales y a los vidrios que, lejos de ser sinónimos -dentro de la química, me refiero- representan dos estados totalmente opuestos.
 |
 |
|
Un diamante (izquierda) y su estructura cristalina (derecha) |
|
Comencemos por los cristales. Un cristal es, simplemente, un sólido cuyas partículas constituyentes -átomos, moléculas o iones- están ordenadas siguiendo un patrón geométrico tridimensional determinado. Un ejemplo de cristal sería el diamante, con los átomos de carbono distribuidos de forma que cada uno de ellos está unido a otros cuatro formando un tetraedro. Otro sería la sal común, o cloruro sódico, formada por iones negativos -o aniones- cloruro e iones positivos -o cationes- de sodio; aquí los aniones y los cationes se intercalan alternativamente formando una red cúbica. Aunque el patrón geométrico puede variar dentro de varios modelos, siempre en un cristal tiene que haber simetría.
Conviene advertir, por ser éste un error común, que un cristal no tiene por qué ser transparente; puede serlo, como ocurre en los dos casos citados o en el del cristal de roca, una variedad de cuarzo, pero no es en modo alguno necesario. De hecho la mayoría de los cristales no lo son, tal como es el caso de minerales como la pirita, la galena o el sílex, otra variedad diferente de cuarzo.
 |
 |
|
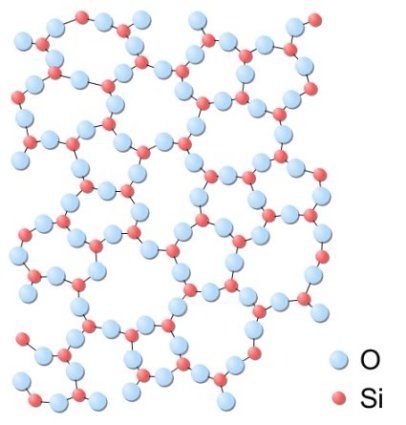
La obsidiana, un vidrio natural de origen volcánico (izquierda) y estructura amorfa de un vidrio de sílice (derecha) |
|
Pasemos ahora a los vidrios. Un vidrio por definición es amorfo, es decir, su estructura interna no sigue pauta geométrica alguna al estar las partículas que lo constituyen distribuidas al azar. El ejemplo más conocido de vidrio es sin duda el vidrio común, mal llamado cristal, es decir, el de las ventanas y las botellas, pero evidentemente hay muchos más. Al igual que en el caso anterior un vidrio puede presentar o no transparencia.
De hecho la estructura amorfa de los vidrios es en todo similar a la de los líquidos, con la diferencia de que en un vidrio las partículas están inmóviles mientras que en los líquidos éstas poseen movilidad, pudiendo desplazarse las unas sobre las otras. Por esta razón, a los vidrios se les suele denominar también líquidos subenfriados, por tratarse en realidad -desde un punto de vista físico- de líquidos en los cuales la temperatura es lo suficientemente baja -la movilidad molecular depende de la temperatura- como para impedir sus desplazamientos.
Así pues, ya tenemos dos tipos muy diferentes de sólidos, los cristales y los vidrios. Pero, ¿existen todavía más? Pues sí, ya que éstos son en realidad los dos casos límite -orden total y desorden total- de toda una batería de posibilidades intermedias, de la misma manera que una escala de grises complementa a los colores blanco y negro. Obviamente, se tratará en todos los casos de sistemas con un orden -o un desorden- parcial, dependiendo de cómo sea éste para que tengamos uno u otro tipo de las denominadas por ello mesofases, o fases intermedias.
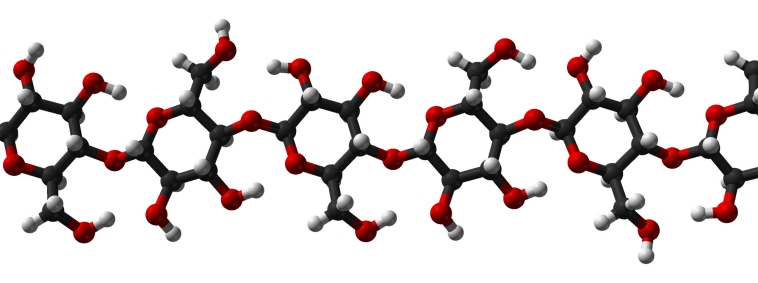
Modelo molecular de celulosa, un polímero
natural.
Un caso interesante lo constituyen los polímeros. Tal como he comentado se trata de materiales semicristalinos, es decir, cristalizados tan sólo parcialmente, pero con una estructura interior sumamente interesante debido a su propia constitución química.
Los polímeros, o macromoléculas, son como sus dos nombres indican -poli = muchas, meros = unidades; macro = grande- moléculas de un tamaño mucho mayor al de las normales o, más exactamente, cadenas ensambladas de las mismas tal como lo son los eslabones de una cadena. Se trata de unos materiales sumamente habituales, ya que comprenden a los popularmente denominados plásticos -aunque no todos lo son- junto con otras muchas substancias naturales como las proteínas, la celulosa o el almidón.
¿Cuál es la diferencia, de cara a la estructura de sus respectivos sólidos, entre una substancia no polimérica y un polímero? Pues precisamente el tamaño de sus unidades estructurales. En el cristal de un material no polimérico, tanto si está formado por átomos -el diamante-, moléculas -el azúcar- o iones -la sal común-, el tamaño de las redes cristalinas es superior al de las partículas que lo componen, razón por la cual cada nodo de esta red -los puntos que la dibujan- está ocupado por una única partícula, sea un átomo de carbono, una molécula de sacarosa o un ión cloruro. Y la cristalinidad, obviamente, es del cien por cien -todas las partículas están ordenadas- salvo el pequeño porcentaje de defectos y de impurezas que siempre está presente en cualquier material, sea éste del tipo que sea.
Pero en los polímeros la situación cambia por completo dado que sus grandes moléculas abultan mucho más que el espacio perteneciente al nodo de la red, por lo que se extienden por una región más o menos extensa de la misma. Y como ésta sigue una determinada distribución geométrica, las moléculas poliméricas no tienen otra opción que la de plegarse ordenadamente para respetarla.
Las macromoléculas, al igual que ocurre con una cadena, tienen un cierto grado de flexibilidad, pero éste no es ilimitado. Por decirlo de una manera gráfica, utilizando el símil que empleaba un profesor mío de química, resulta francamente difícil cristalizar -o empaquetar- un plato de angulas, o de espaguetis. A ello se suma la dificultad añadida de que no todas las moléculas son de igual longitud -en realidad son cadenas con un número mayor o menor de eslabones-, al tiempo que también suelen presentar lo que los químicos llamamos “defectos”: ramificaciones, roturas, pliegues, entrecruzamientos y, en general, cualquier otro tipo de alteraciones que puedan romper la secuencia sistemática y en teoría siempre igual de una macromolécula ideal.
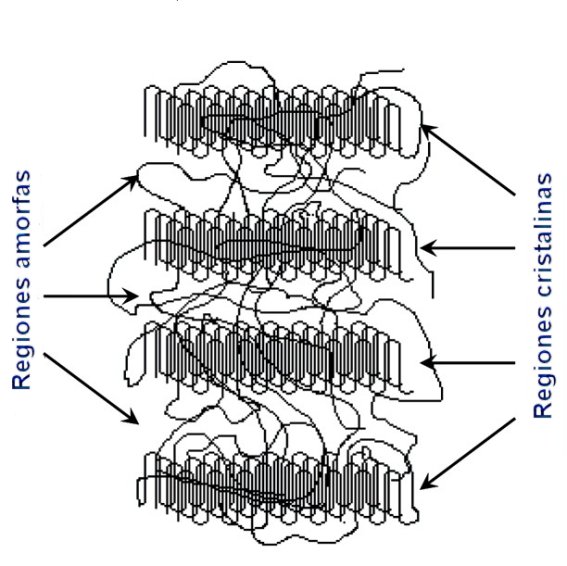
Estructura de un polímero
semicristalino, con regiones cristalinas y amorfas intercaladas
El resultado de estas dos tendencias contrarias, la necesidad de respetar las pautas geométricas del cristal y la dificultad de las largas moléculas poliméricas para plegarse de forma ordenada, se traduce en un empate: ésta es la razón por la que los polímeros, en la práctica, son materiales semicristalinos, con regiones cristalinas -es decir, ordenadas- intercaladas con otras amorfas, con unos porcentajes de cristalinidad que difícilmente suelen exceder de un 50% de la masa total, aunque muchas veces este porcentaje es inferior. Puesto que la distribución de estos dos tipos de regiones determina unas superestructuras sumamente complejas, el estudio de la cristalinidad de los polímeros, área en la que desarrollo mi actividad investigadora, puede dar realmente mucho juego... incluida mi propia tesis doctoral.
En los polímeros nos encontramos también con un nuevo concepto asimismo interesante, el de la transición vítrea. En realidad no se trata de algo privativo de este tipo de materiales sino común a todos los sólidos amorfos o semicristalinos -es decir, semiamorfos-, aunque es en los polímeros donde reviste especial importancia. Para entender lo que significa la transición vítrea, debemos tener claro primero la diferencia de comportamiento entre un material totalmente cristalino y otro totalmente amorfo cuando a ambos se les calienta: mientras el primero, llegado a determinada temperatura, se funde convirtiéndose en un líquido, un material amorfo no funde, sino que simplemente se va reblandeciendo de forma paulatina conforme aumenta su temperatura. Esto se debe a que un sólido amorfo no es en realidad, vuelvo a repetirlo, sino un líquido en el que las partículas que lo componen están “bloqueadas” -evito utilizar el término “congelado”, porque éste es más bien aplicable al proceso mediante el cual un líquido se transforma en un sólido cristalino- no pudiéndose deslizar entre ellas, produciéndose un “desbloqueo” paulatino conforme éstas van adquiriendo una mayor temperatura que influye, entre otros procesos, en una disminución de la viscosidad, lo que permite que las partículas puedan empezar a moverse.
Sin embargo, dentro de este proceso de reblandecimiento suele tener lugar un fenómeno -la aludida transición vítrea- que, al igual que ocurre en los cambios de fase, provoca una modificación en las propiedades del material. ¿Cuál? El paso de la rigidez a la flexibilidad, si se calienta, o viceversa si se enfría.
¿Se han parado a pensar la razón por la que algunos plásticos son flexibles, como el polietileno de las bolsas de la compra, mientras otros son rígidos como el metacrilato? Este distinto comportamiento se debe a que, a temperatura ambiente, el primero está por encima de su transición vítrea -que cae bastante por debajo de los cero grados-, por lo cual sus moléculas, aunque no puedan desplazarse libremente como en un líquido, sí gozan de la suficiente libertad de movimientos como para proporcionarle esa flexibilidad. El metacrilato, por el contrario, tiene su transición vítrea en torno a los 120º, lo que explica su rigidez. Sin embargo, bastaría con calentar al metacrilato por encima de este valor para flexibilizarlo, mientras que si enfriáramos al polietileno por debajo de la suya, por ejemplo introduciéndolo en nitrógeno líquido, obtendríamos un material completamente rígido. Por esta razón los polímeros semicristalinos presentan lo que pudiéramos denominar dos transiciones de fase -aunque la transición vítrea, en sentido estricto, no es un cambio de fase propiamente dicho-, la transición vítrea de la fracción amorfa y, a temperaturas más elevadas, la fusión de la fracción cristalina.
¿Pensaban ustedes que ya habíamos terminado? Pues todavía nos queda bastante de que hablar. ¿Han oído hablar de los cristales líquidos? Seguro que sí. ¿Saben de qué se trata? Es muy posible que no. Así pues, si me lo permiten, paso a explicárselo.
Y para ello, es necesario volver al concepto de cristal. Anteriormente había definido al cristal como a un sólido en el cual sus partículas constituyentes están distribuidas siguiendo un determinado orden geométrico, y ahora añado lo siguiente: en las tres dimensiones. Es decir, un cristal siempre es tridimensional, y si tomamos por ejemplo un cubo de pirita veremos que la estructura cristalina, cúbica en este caso concreto, se extiende a lo largo, a lo ancho y a lo alto del citado cristal. Aunque en otras ocasiones un cristal pueda presentar simetrías diferentes como prismáticas o piramidales, éste siempre se extiende a lo largo de las citadas tres dimensiones.

Diversas estructuras
de cristales líquidos
Ahora bien, ¿qué pasaría si un material fuera cristalino -es decir, estuviera ordenado- tan sólo en dos dimensiones, o incluso en una sola, faltándole el orden en las restantes? Pues que entonces tendríamos precisamente un cristal líquido, llamados así porque presentan unas propiedades físicas intermedias entre un sólido cristalino y un líquido.
Puesto que un cristal líquido tiene una componente cristalina y otra amorfa -la líquida-, cabría preguntarse qué diferencia hay entre éstos y los polímeros, ya que en ambos casos podemos hablar de materiales semicristalinos. Ésta existe, y es fácil de comprender: en un polímero tanto las regiones cristalinas como las amorfas son tridimensionales, es decir, se extienden a través de las tres dimensiones del espacio, mientras en los cristales líquidos su condición cristalina o amorfa depende del eje que consideremos.

Los espárragos, un buen
símil de los cristales líquidos nemáticos
Veamos un ejemplo. Imagínense ustedes que tienen un manojo de espárragos, o de espaguetis crudos, colocados todos ellos -es la forma más sencilla de hacerlo- de forma paralela y contigua. Si los miran desde arriba o desde abajo, es decir, por los extremos, verán que no hay ningún orden en su colocación, son simplemente cilindros puestos uno al lado del otro. Sin embargo, si lo miran de lado verán que todos los cilindros están perfectamente ordenados de forma paralela, siguiendo un eje. Dicho con otras palabras, el manojo es “cristalino” en una dirección -la paralela a la longitud de sus componentes- y “amorfo” en las otras dos, las que determinan el plano perpendicular a este eje. Si en vez de cilindros tuviéramos discos planos, como por ejemplo monedas o botones desparramados sobre una mesa, éstos se distribuirían al azar pero siempre dentro de un mismo plano, por lo cual ahora la “cristalinidad” afectaría a dos dimensiones -las del plano de la mesa- y la condición amorfa a la restante.

Y los botones, de los cristales
líquidos esmécticos
Como puede deducirse, los tipos posibles de cristales líquidos son varios en función de su geometría particular. Así, los nemáticos -del griego nema, hilo- son aquéllos en los que las moléculas se encuentran desordenadas pero sus ejes se orientan en una misma dirección, mientras en los esmécticos las moléculas, aunque también desordenadas, se disponen en capas. Serían, pues, los equivalentes, respectivamente, a nuestros espárragos y botones. Pero existen otros muchos tipos como por ejemplo los colestéricos, en los que la distribución geométrica sigue una pauta helicoidal a través de una acumulación de capas.

Las moléculas de los
cristales plásticos se pueden mover, pero poco
Y de los cristales líquidos, a los cristales plásticos. ¿Qué tienen de particular estos últimos? En ellos, aunque las moléculas que los constituyen están ordenadas formando un cristal tridimensional, éstas tienen cierta libertad de movimiento, pudiendo rotar en torno a su centro de masas, pero sin abandonarlo. Recurriendo a un nuevo símil, imaginemos a un perro atado a un poste con una cadena; podrá dar vueltas en torno al poste, pero sin alejarse de éste más de lo que le permita la longitud de los eslabones. Evidentemente los cristales plásticos nada tienen que ver con los impropiamente denominados cristales orgánicos utilizados en la confección de lentes para las gafas, ya que estos últimos son en realidad polímeros “normales” tales como los policarbonatos.
 |
 |
|
Estructura de un cuasicristal (izquierda) y azulejo de la Alhambra (derecha) |
|
Para terminar conviene recordar también a los cuasicristales, últimamente de moda puesto que han sido éstos el tema de investigación premiado con el Nobel de Química de 2011. Como su nombre indica son “casi cristales”, poseyendo una estructura ordenada -como los cristales verdaderos- pero no periódica. Para visualizarlos, podríamos considerar un suelo, o una pared, adornados con un mismo dibujo -pongamos una flor- que se repite a lo largo de toda su superficie, pero no de una manera regular sino al azar. Se trata de un descubrimiento muy reciente -fueron descritos por vez primera en 1984- pero con interesantes propiedades geométricas y, quién sabe, quizá también tecnológicas. Curiosamente algunas obras de arte musulmán, tales como los azulejos de la Alhambra, recuerdan poderosamente a las estructuras de los cuasicristales... pese a ser varios siglos anteriores a su descubrimiento.
Después de leer todo esto, ¿todavía siguen pensando que los estados de la materia son tan sólo tres?
Publicado el 21-10-2011
Actualizado el
6-5-2014
