
La sorprendente versatilidad del carbono
(I) Sus
estados alotrópicos
 |
 |
|
Diamante (izquierda) y grafito (derecha), los dos principales estados alotrópicos del carbono |
|
Hasta hace relativamente pocos años, los libros de texto decían que existían dos estados alotrópicos distintos del carbono, el diamante y el grafito, y tan sólo los más especializados añadían un tanto dubitativamente a un tercero, el negro de humo o negro de carbono, en realidad una variante pulverulenta del grafito. En cuanto al carbón en sus diferentes variantes, aunque también está compuesto mayoritariamente de carbono, es químicamente impuro, por lo cual podemos olvidarnos de él sin ningún remordimiento de conciencia.
Antes de seguir adelante quizá sea conveniente hacer una aclaración. Los químicos denominamos alotropía al fenómeno mediante el cual un elemento químico se puede presentar en dos o más formas distintas; se trata de algo similar, hasta cierto punto, a la isomería, con la diferencia de que ésta se da en compuestos, mientras la alotropía es propia de los elementos químicos puros.
Conviene no confundir alótropo con isótopo, ya que el primer término alude a la forma en la que se agregan los átomos -normalmente no tenemos uno, sino una acumulación de muchos-, mientras los isótopos muestran diferencias en su estructura nuclear, con el mismo número de protones y electrones -que es lo que caracteriza a un elemento químico determinado- pero con diferente cantidad de neutrones.
Por definición dos alótropos tienen idéntica composición química, la del elemento en cuestión, diferenciándose tan sólo en la forma en la que sus átomos, o sus moléculas, están ordenados… lo cual en ocasiones es suficiente para que sus propiedades físicas -no las químicas- varíen espectacularmente de uno a otro.
Éste es el caso, precisamente, del diamante y el grafito. Pese a que ambos son carbono puro, es evidente que nadie confundiría un diamante con un pedazo de grafito… ¿a qué se debe, pues, tan llamativa diferencia?

Estructura cristalina del
diamante
La explicación está en la forma en que se agregan los átomos de carbono en uno y otro. En el diamante cada átomo está unido a otros cuatro por fuertes enlaces químicos formando un tetraedro. Puesto que cada uno de estos cuatro átomos está unido a su vez a otros tantos formando sendos tetraedros, de todo ello resulta una red cristalina muy compacta que es la que da al diamante sus principales características, en especial su extrema dureza.
Pasemos ahora al grafito. El carbono tiene la particularidad de poder formar varios tipos de enlaces distintos, un fenómeno sobre el que no me extenderé aquí puesto que merece ser tratado en un artículo aparte. En consecuencia los átomos no se distribuyen, como en el caso anterior, en una red tridimensional tetraédrica, sino en una red hexagonal plana. Ahora cada átomo de carbono no está rodeado por cuatro átomos por arriba y por abajo, sino que cada seis de ellos forman un hexágono regular que a su vez está rodeado por otros hexágonos, creando algo parecido a un mosaico cuyas piezas son estas figuras geométricas. A su vez estas láminas se apilan entre sí formando algo que podríamos comparar con un hojaldre; es esto último a lo que llamamos grafito, ya que una lámina aislada -el grafeno del que hablaremos más adelante- es tan delgada -tiene aproximadamente el espesor de un átomo- que no ha podido ser obtenida de forma aislada sino hasta fechas muy recientes.
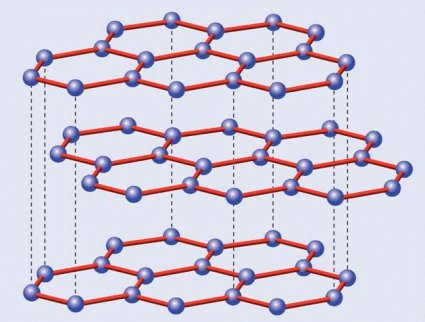
Estructura cristalina del grafito
¿Por qué razón, a diferencia del diamante, el grafito es tan blando? La explicación la da su propia estructura. Romper la red de hexágonos es difícil, pero separar las láminas resulta mucho más fácil, dado que las fuerzas que las unen son mucho más débiles que las existentes entre los carbonos de una misma capa… o de un cristal de diamante. Volviendo a la analogía del hojaldre, es inmediato deducir que resulta mucho más sencillo separar las hojas con un cuchillo que intentar partirlo en sentido transversal sin destrozarlo.
Esta diferencia entre ambas estructuras cristalinas marca también sus otras propiedades además de la dureza. El diamante es transparente y, cuando está libre de impurezas, también incoloro; el grafito, por el contrario, es negro. El diamante es un aislante eléctrico perfecto, mientras el grafito es conductor gracias a que su red hexagonal permite el movimiento libre de los electrones por ella, algo que no es posible en los rígidos enlaces tetraédricos del primero. Y el diamante es una joya, mientras el grafito se usa hasta en los lápices; esto último indica tanto la escasez de aquél como la abundancia de éste, a lo que se suma una serie de aplicaciones industriales inexistentes en los bonitos, pero tecnológicamente mucho más inútiles diamantes… salvo en lo referente a su dureza, por lo que los diamantes industriales, sin valor en joyería, se utilizan para perforar materiales asimismo muy duros.
Aclarado esto, ahora podemos volver al principio: desde hace unos años el número de estados alotrópicos del carbono se ha multiplicado notablemente, dando cabida a toda una serie de materiales sumamente interesantes tanto desde el punto de vista científico como en lo que respecta a sus posibles aplicaciones tecnológicas, lo cual no es precisamente moco de pavo. En realidad todos estos nuevos estados alotrópicos pueden considerarse derivados de las dos estructuras básicas del grafito -o del grafeno- y del diamante, lo que no es óbice para que su descubrimiento haya abierto nuevas vías de impredecibles consecuencias.

Las nanofibras de carbono
vistas a través del microscopio electrónico
Desde un punto de vista cronológico el primero de ellos son las nanofibras de carbono, que pueden ser definidas como fibras de carbono amorfo, es decir, sin estructura cristalina definida, aunque en realidad son más bien agregados filamentosos de micropartículas de grafito distribuidas al azar. Fueron descritas por vez primera en 1953 por W.R. Davis, R.J. Slawson y G.R. Rigby, y durante mucho tiempo no pasaron de ser una curiosidad científica. Hoy, por el contrario, están siendo investigadas intensamente ya que, mezcladas en pequeñas cantidades con materiales aislantes tales como ciertos tipos de plásticos, confieren a éstos conductividad eléctrica, un fenómeno con interesantes aplicaciones prácticas.
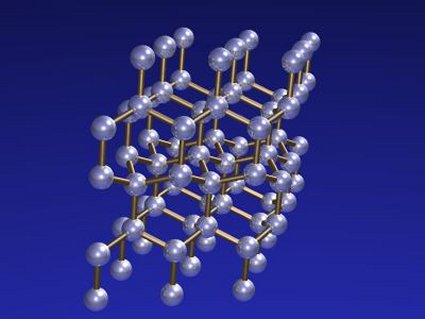
Estructura cristalina de la
lonsdaleíta
De 1967 data el hallazgo de la lonsdaleíta, en esta ocasión emparentada con el diamante aunque con una estructura cristalina distinta, hexagonal en vez de la tetraédrica de éste. Esta red hexagonal es tridimensional, lo que la diferencia de la red plana del grafito. Se trata de un material exótico que se ha encontrado tan sólo en pequeñas trazas asociadas a impactos meteóricos, por lo que su interés no pasa de ser académico, aunque según algunos estudios sería todavía más dura que el diamante. Debe su extraño nombre a la cristalógrafa irlandesa Kathleen Lonsdale (1903-1971).
Mucha más repercusión fuera de los círculos científicos alcanzaron los fullerenos, cuya fecha oficial de descubrimiento es 1985. Estos curiosos materiales están formados por redes hexagonales, o pentagonales, de carbonos similares a las del grafito, diferenciándose de éstas en que, en vez de ser planas, se curvan formando diversos poliedros. El símil más prosaico de los fullerenos es el de un balón de fútbol de reglamento, con su superficie seudoesférica formada por un mosaico de hexágonos y pentágonos intercalados, aunque se trata de uno solo de los distintos poliedros posibles.
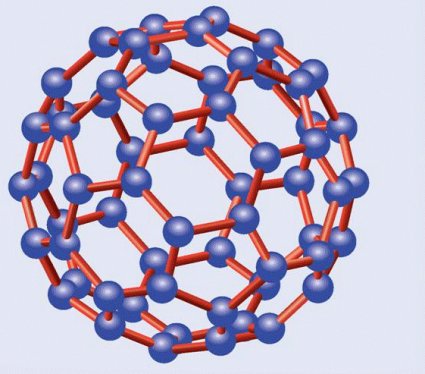
C60, el principal fullereno
Sus descubridores fueron, entre otros investigadores, Harold Kroto, Robert Curl y Richard Smalley, los cuales fueron galardonados con el Premio Nobel de Química en 1996. En cuanto a su nombre, éste es un homenaje al arquitecto norteamericano Richard Buckminster Fuller (1895-1983), famoso por diseñar unas espectaculares cúpulas geodésicas que recuerdan por su forma a las estructuras de los fullerenos.
Dado que la estructura de la capa electrónica de los átomos de carbono sólo permite la formación de determinadas configuraciones geométricas, que en el caso de los fullerenos son tan sólo hexágonos y pentágonos planos, o casi planos, el número posible de fullerenos es limitado, correspondiendo cada uno de ellos a un poliedro determinado. Puesto que los ángulos de un pentágono regular miden 108º, 12 menos que los de un hexágono, los enlaces entre los carbonos que los forman están algo forzados, pero esta dificultad queda compensada por la estabilidad que confiere la estructura poliédrica del conjunto.
El más importante de los fullerenos es el C60, denominado así por contar con un total de sesenta átomos de carbono, los cuales forman una estructura constituida por 20 hexágonos y 20 pentágonos alternados, formando el balón de fútbol al que hice alusión. Por esta razón se le ha denominado con los informales nombres de futboleno o buckybola, aunque su nombre oficial, aparte del prosaico C60, es el de buckminsterfulereno. Otro fullereno importante es el C70, con diez átomos de carbono más y forma de balón de rugby, o de melón. También los hay más pequeños, como el C20, con doce pentágonos y forma de dodecaedro regular, y más grandes, como el C76, el C84 y el C540.
Todos ellos tienen en común ser estructuras geométricas cerradas y tridimensionales, aunque a diferencia del diamante todos los átomos de carbono se sitúan sobre la superficie, dejando vacío el volumen interior. Además el número de carbonos que los constituyen es siempre limitado y el mismo para cada uno de ellos, mientras que en el grafito o en el diamante las redes cristalinas bi o tridimensionales se extienden sin límite definido formando una única estructura.
Aunque lo reciente de su descubrimiento hace que sus aplicaciones tecnológicas sean todavía limitadas, se trabaja con ellos en varias líneas diferentes de investigación que van desde su posible uso en medicina hasta la posibilidad de utilizarlos para reacciones químicas exóticas, aprovechando su capacidad para enjaular en su interior átomos, moléculas o iones de otros elementos o compuestos químicos. Como curiosidad, cabe añadir que se han detectado fullerenos libres en algunas regiones del universo.
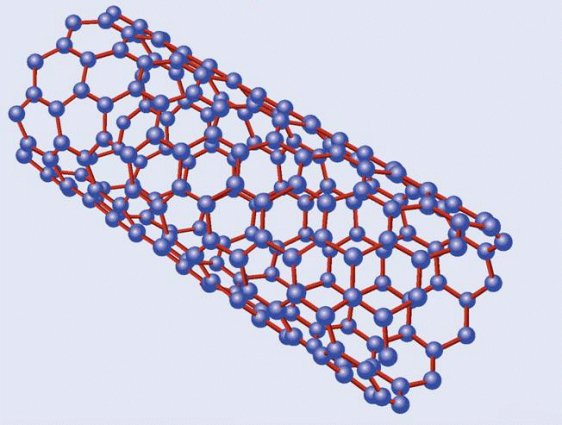
Estructura de un
nanotubo de carbono
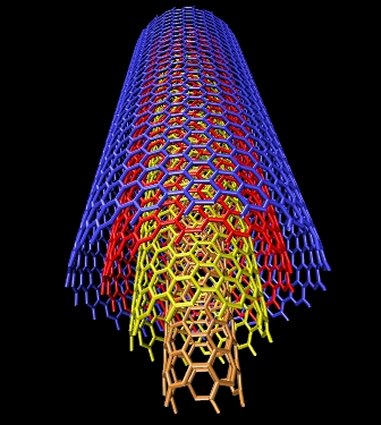
Emparentados con los fullerenos están los nanotubos de carbono, descritos por vez primera por Suomo Iijima en 1991. La estructura de ambos es similar, pero a diferencia de los fullerenos los nanotubos no forman poliedros sino, como su nombre indica, tubos de tamaño nanométrico, un millón de veces menores que un milímetro. Volviendo a nuestros símiles un nanotubo sería algo así como un barquillo, con una o varias láminas de grafeno enrolladas en forma de cilindro. Dependiendo de la manera en la que se enrollan, o del número de capas que los forman, existen diversos tipos de nanotubos, siendo los principales los nanotubos monocapa, los haces de nanotubos monocapa y los nanotubos multicapa. Los primeros están formados por una única capa, y a su vez se subdividen en varias categorías según sea la distribución geométrica de los hexágonos que la componen. Los segundos serían algo así como un haz de macarrones -crudos, evidentemente- y los terceros, por último, están formados por un conjunto de varias capas concéntricas enrolladas en torno al eje común, envolviendo cada una de ellas a todas las interiores.
 |
 |
|
Diversas variantes de los nanotubos monocapa (izquierda) y estructura de los nanotubos multicapa (derecha) |
|
Los nanotubos, al igual que los barquillos o los macarrones con los que los hemos comparado, tienen ambos extremos abiertos. En cuanto a sus aplicaciones tecnológicas, están siendo intensamente investigados ya que resultan prometedores en varios ámbitos de la industria, desde la medicina hasta la electrónica y la informática, pasando por algunas tan prosaicas como la automovilística o la aeronáutica.
Más exóticas que los anteriores resultan ser las nanoespumas (nanofoams) de carbono, descubiertas en 1997 por el equipo encabezado por Andrei V. Rode. Tal como indica su nombre tienen una estructura porosa o, por decirlo con mayor propiedad, nanoporosa. Su densidad es muy baja, y su comportamiento similar al de un aerogel.
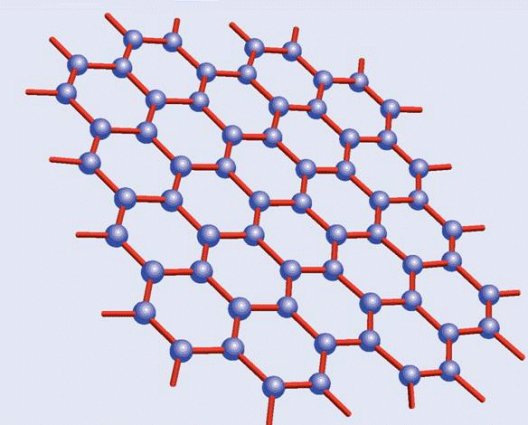
Estructura del
grafeno
Y por fin llegamos al grafeno, varias veces citado en el artículo. El grafeno, como ya apunté, es simplemente una lámina única de grafito, algo que, pese a ser descrito teóricamente en la década de 1930, no pudo ser aislado -el grafito presenta múltiples láminas apiladas- hasta 2004, trabajo que les valió el Premio Nobel de Física de 2010 a a Andre Geim y Konstantin Novoselov. En contra de lo que pudiera parecer, el grafeno aislado presenta interesantes propiedades sobre el grafito normal, amén de ser la materia prima potencial para la fabricación de otros alótropos del carbono. Aunque todavía es demasiado pronto para hablar de aplicaciones tecnológicas consolidadas, el grafeno se apunta como el candidato ideal para crear una nueva generación de chips informáticos en sustitución de los actuales de silicio.

Nanocilindros de
carbono vistos al microscopio
De 2005 datan los nanocilindros de carbono, nanorods en inglés. Sometiendo a los fullerenos a altas presiones (200.000 atmósferas) y altas temperaturas (2.200 grados centígrados), un equipo de físicos alemanes encabezado por Natalia Dubrovinskaia logró convertirlos en nanocilindros, pequeños hilos de unos pocos nanometros -un nanometro es la millonésima parte de un milímetro- de espesor. Los nanocilindros se diferencian de los nanotubos en que su estructura no es grafítica, sino similar al diamante -son una especie de agregados de diamante-, siendo incluso más duros que éste. También se les conoce como nanodiamantes o hiperdiamantes.

Diversas estructuras
de nanoyemas de carbono
En 2007 aparecieron las nanoyemas de carbono, o nanobuds en la terminología inglesa. Descritas por vez primera por un equipo de investigadores finlandeses formado por Esko Kauppinen, David Brown, Nasibulin Albert y Jiang Hua, se puede definir a las nanoyemas como estructuras híbridas entre los nanotubos y los fullerenos, con las estructuras poliédricas de los segundos ancladas en las paredes de los primeros. Sus propiedades físicas son asimismo una combinación de las de ambos, lo cual les proporciona interesantes expectativas de uso.

Simulación por ordenador
de una lámina de grafino
Actualmente se está investigando sobre diversos derivados del grafeno, muchos de los cuales todavía no han pasado de la fase de los modelos teóricos, siendo el más importante de ellos el grafino. Aunque la estructura básica del grafino es también una lámina plana formada por una red de átomos de carbono, se diferencia del grafeno en que los anillos hexagonales no están contiguos, sino enlazados a través de cadenas lineales formadas por dos carbonos acetilénicos; puesto que explico este tipo de enlaces en el artículo correspondiente a la química del carbono, no me extenderé aquí. El resultado no es ya un diseño en forma de panal de abeja, sino otro más complejo con dos tipos diferentes de huecos, los hexágonos y otros, alternados con éstos, de mayor tamaño y forma aproximadamente triangular, el cual recuerda bastante a algunos tipos de redes de pesca. Jugando con la longitud de las cadenas acetilénicas se pueden conseguir otras estructuras similares pero con diferentes tamaños de huecos, lo que en teoría permitiría ajustar prácticamente a medida las propiedades físicas y tecnológicas de estos compuestos... aunque de momento no se haya conseguido sintetizarlos.
Todavía existen algunos otros alótropos del carbono de menor importancia, al menos por el momento, tales como el carbono vítreo, el carbono acetilénico lineal o el carbono metálico. pero con lo dicho hasta ahora es suficiente… aunque quizá no lo sea en un futuro. En cualquier caso, el carbono demuestra que es capaz de darnos muchas sorpresas.
Ver también: La sorprendente versatilidad del carbono. (II) Su química.
Publicado el 11-11-2010
Actualizado el
23-5-2014
 CLASS="foto">
CLASS="foto">