
¿Por qué el alcohol es de 96º y no de 100º?

Uno de los compuestos químicos más comunes en nuestras casas es sin duda el alcohol, usado generalmente como desinfectante aunque también tiene una notable utilidad, combinado con el jabón, como limpiador de manchas difíciles. Está presente asimismo en múltiples sectores, desde cosméticos y perfumes hasta medicamentos -como excipiente-, productos de droguería y limpieza e infinidad de procesos industriales, sin olvidarnos del importante mercado de las bebidas alcohólicas.
Lo que conocemos como alcohol es, en sentido estricto, el alcohol etílico o etanol; existen muchos alcoholes diferentes, de los cuales los más habituales son, además de éste, el metílico o metanol, también conocido tiempo atrás como alcohol de quemar, ya que se usaba como combustible; el isopropílico o isopropanol, utilizado como desinfectante, disolvente y limpiador; el etilenglicol, componente básico de los anticongelantes, o la glicerina, un componente de las grasas muy utilizado para la fabricación de cosméticos y como excipiente de medicamentos. Pero al ser el alcohol etílico con diferencia el más común, en el lenguaje coloquial se le suele conocer simplemente como alcohol.
Si se fijan ustedes en la etiqueta de la botellita de alcohol -habitualmente suelen ser de 250 centímetros cúbicos-, verán que el nombre viene seguido por un 96º, es decir, 96 grados. Este número hace referencia a su concentración, que es de un 96% de alcohol correspondiendo al agua el 4% restante. Bueno, esto había sido siempre lo habitual, puesto que a raíz del surgimiento de la pandemia del coronavirus, aparecieron en el mercado mezclas más rebajadas como el alcohol de 70º, con un 30% de agua, o los geles hidroalcohólicos, con alrededor de un 80% de etanol, isopropanol o una mezcla de ambos, glicerina para aportarle la consistencia viscosa, y pequeñas cantidades de otros aditivos como el agua oxigenada, aromas o la propia agua.
Aunque desde un punto de vista objetivo cabe presumir que la menor cantidad de alcohol presente en la mezcla de 70% o en el gel hidroalcohólico -la glicerina no desinfecta- frente al de 96% se corresponderá con una merma de su capacidad desinfectante, lo cierto es que estas preparaciones inundaron el mercado a precios muy superiores al del alcohol de toda la vida, cuya presencia en las estanterías de muchos supermercados desapareció prácticamente por completo, al tiempo que incrementaba de forma notable su precio en otros canales de venta. ¿Casualidad? Dejémoslo aquí.
Volviendo a la pregunta planteada en el título, cabría plantearse por qué el alcohol utilizado como desinfectante es de 96º y no de 100º, es decir, puro. ¿A qué se debe, pues, ese 4% de agua?
Para ello, tendremos que recordar brevemente sus propiedades químicas y físicas. El alcohol -a partir de ahora me referiré siempre al etílico, aunque por sencillez omitiré el adjetivo- es un compuesto cuya molécula está formada por dos átomos de carbono enlazados entre sí. Uno de ellos lo está a su vez con tres de hidrógeno, mientras el segundo está unido a dos átomos de hidrógeno y a un grupo hidroxilo, formado por un átomo de oxígeno y otro de hidrógeno. Escrito en terminología química sería así:
| H | H | |||||||
| | | | | |||||||
| H | — | C | — | C | — | O | — | H |
| | | | | |||||||
| H | H |
Es el grupo hidroxilo -OH, presente en todos los alcoholes, el que le aporta sus propiedades, tal como veremos a continuación. El alcohol se puede obtener por diferentes vías, aunque con independencia de cual sea ésta el resultado es químicamente idéntico.
La más antigua, conocida desde la antigüedad, es la fermentación de azúcares o hidratos de carbono por levaduras, un método por el que se obtienen bebidas tan comunes como el vino, la cerveza o la sidra. Puesto que la fermentación natural da como máximo unas concentraciones de alrededor de un 15% de alcohol, es necesario someterlas a destilación para obtener mayores concentraciones de éste tal como ocurre con los licores, los aguardientes y, ya para usos ajenos al paladar, con el alcohol utilizado como desinfectante o como combustible.
El bioetanol se diferencia del anterior en que se obtiene sometiendo a determinados tratamientos químicos -no es necesario entrar en detalles- a la madera o a los residuos vegetales producidos por la agricultura. Aunque químicamente es idéntico al anterior, dado su origen no es apto para consumo humano, por lo que se utiliza como combustible, generalmente mezclado con derivados del petróleo, o para usos industriales.
El alcohol sintético, por último, se obtiene mediante una reacción química entre el acetileno -un gas obtenido en las refinerías de petróleo- y el agua. Al igual que en el caso anterior es indistinguible químicamente del procedente de la fermentación, pero asimismo tampoco es apto para el consumo humano.
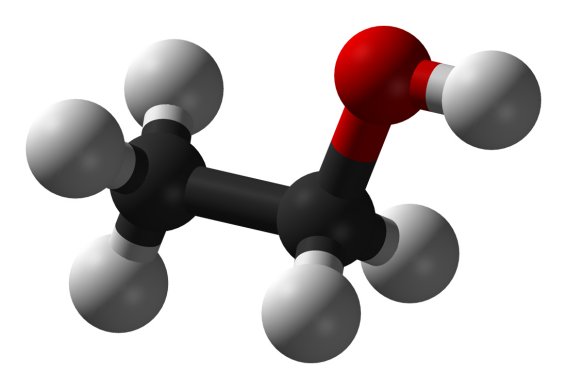
Estructura molecular
del etanol. Los átomos de carbono estan marcados
en negro, los de
hidrógeno en gris y el de oxígeno en rojo
Puesto que estamos hablando del alcohol como desinfectante -externo, añado, para prevenir el chiste malo del borracho que se desinfectaba por dentro-, huelga decir que si éste es convenientemente puro -alguna impureza podría acarrear efectos secundarios indeseados-, resulta indiferente cual pueda ser su origen. En cuanto a la cantidad de agua que le acompaña, el método habitual para eliminarla, tal como he explicado, es la destilación... hasta llegar a los 96º. ¿Qué pasa con el 4% restante?
Aquí necesitamos recurrir a un poquito de química y de física. Ya que todos tenemos claro, supongo, el concepto de solubilidad, voy a pasar directamente a su equivalente en una mezcla de líquidos, la miscibilidad. Si nosotros tomamos dos líquidos puros y los juntamos, puede ser que éstos se mezclen, si son miscibles, o que no se mezclen si son inmiscibles, tal como ocurre con el agua y el aceite. La miscibilidad no tiene por qué ser total, y dependiendo de la naturaleza de los compuestos que mezclemos sólo podremos alcanzar un porcentaje máximo por encima del cual el exceso quedará separado de la mezcla.
No es éste el caso del agua y el alcohol ya que ambos son miscibles en cualquier proporción, razón por la que, sea cual sea su método de obtención, siempre nos encontraremos con una mezcla de ambos. Por lo tanto, si lo que nos interesa es el alcohol puro, tendremos que eliminar el agua.
Esto se hace, como he comentado, mediante una destilación. La destilación es una técnica sencilla que se basa en la diferencia entre los puntos de ebullición de dos líquidos que estén mezclados. Mientras el agua, como es sabido, hierve aproximadamente a 100º centígrados en condiciones normales -depende de la presión atmosférica y de las sustancias que pueda llevan disueltas-, el alcohol es más volátil, puesto que lo hace a los 78,5º. Esta diferencia hace que el alcohol hierva antes que el agua, por lo que si calentamos una mezcla de agua y alcohol llevándola hasta la ebullición, recogemos los vapores y los condensamos en un segundo recipiente, tal como se hace en los alambiques, obtendremos un líquieo enriquecido en alcohol respecto al inicial.

Alambique tradicional.
Fotografía tomada de la
Wikipedia
Claro está que en la práctica la cuestión es más compleja, pero la esencia del método es ésta. Si lo que pretendemos es simplemente aumentar el grado alcohólico de la mezcla para obtener brandy, whisky, vodka o ron, pongo por caso, la destilación será relativamente sencilla aunque también tiene su técnica, que es lo que diferenciará a una buena bebida de un repelente garrafón. Pero ésta es otra historia.
Si por el contrario lo que queremos es obtener alcohol puro para usarlo como desinfectante, la destilación será más compleja ya que, conforme aumenta la concentración del alcohol, resulta más difícil separar el agua remanente. Para ello se emplea una variante de la destilación simple conocida como destilación fraccionada, que en esencia se trata de una serie de destilaciones simples encadenadas, mediante las cuales se consigue un incremento en la concentración del alcohol conforme se van avanzando etapas. En teoría bastaría con un número suficiente de destilaciones sucesivas para obtener alcohol puro, pero...
Aquí es necesario introducir un concepto que los químicos llamamos azeótropo, palabra que deriva de los términos griegos a (negación), zeo (hervir) y tropo (cambio), por lo que se puede definir como que no cambia al hervir. Dicho en términos más coloquiales, llega un momento en el que, por mucho que sigamos destilando, ya no conseguiremos incrementar la concentración de la sustancia que pretendíamos purificar -el alcohol en este caso-, dado que los puntos de ebullición de los dos componentes se equiparan comportándose como si fuera una sustancia única.
Aunque ya lo he comentado anteriormente, conviene recordar que tanto el punto de ebullición como el de congelación de una sustancia pura no es constante, sino que depende de parámetros como la presión -en eso se basa el funcionamiento de la olla a presión- y de las sustancias que lleve disueltas, razón por la que se añade anticongelante al circuito de refrigeración del coche para evitar que el agua se congele en invierno.
En resumen: en una mezcla de agua y alcohol los puntos de ebullición de ambos son diferentes a los correspondientes en estado puro, y también diferentes entre sí. Esta diferencia es la que permite separarlos, pero conforme la mezcla resultante se va enriqueciendo en alcohol y empobreciéndose en agua, estos puntos de ebullición “temporales” van variando, acercándose el uno al otro hasta acabar coincidiendo en un valor correspondiente a 78,2º centígrados. Es entonces cuando hemos alcanzado el azeótropo y, por mucho que lo intentemos, no conseguiremos eliminar más agua puesto que ésta se evapora exactamente a la misma temperatura que el alcohol, por lo que destilan juntos y no se separan.
¿Adivinan a qué concentración ocurre esto? Pues exactamente cuando la mezcla contiene un 96% de alcohol y un 4% de agua o, para ser más precisos, un 95,6% y un 4,4% respectivamente. ¿Les suena esta cantidad?
Es por ello por lo que el alcohol “puro” se vende con una concentración del 96% y no del 100% o cualquier otro valor intermedio. Ciertamente es posible quitar ese 4% remanente de agua, pero para ello es necesario recurrir a métodos más complejos -y sensiblemente más caros- como una destilación a presión que consigue elevar el porcentaje hasta el 97% -tampoco se gana tanto-, una destilación azeotrópica, que implica la adición de sustancias que rompen el azeótropo agua-alcohol y a las que posteriormente hay que eliminar, o bien añadiendo una sustancia deshidratante que elimine el agua, también con una purificación posterior. Se obtiene así el denominado alcohol absoluto, que se utiliza en determinados procesos químicos y físicos en los que la presencia de agua, aun en cantidades mínimas, provocaría perturbaciones indeseadas.
Por si fuera poco al alcohol absoluto hay que preservarlo en un ambiente completamente seco y manipularlo con cuidado, ya que basta con la humedad ambiente o con el propio aliento para que absorba pequeñas cantidades de agua perdiendo su pureza. Yo lo utilicé en alguna ocasión en el laboratorio, y les puedo asegurar que resultaba engorroso evitar que se contaminara con agua.
Es por ello por lo que para un uso normal no merece la pena eliminar ese 4% de agua residual del alcohol, ya que la merma en su capacidad desinfectante es mínima y se evita un encarecimiento muy considerable. Con esto queda explicado por qué el alcohol comercial es de 96º -si no es de menos- y no de 100º.
Otra cuestión a considerar es el tema de la desnaturalización del alcohol y de otras sustancias de uso cotidiano, pero esto será mejor explicarlo en un artículo aparte.
Publicado el 19-7-2020
